美国威尔·康奈尔医学院科学家开发出一种创新性人类神经元模型,详细模拟了tau蛋白聚集体在大脑内的传播,这一过程会导致阿尔茨海默病和额颞叶痴呆症患者认知能力下降。新模型有助科学家找到可能阻断tau蛋白传播的新治疗靶点,是阿尔茨海默病研究领域的一项重大进展。相关论文发表于5日出版的最新一期《细胞》杂志。
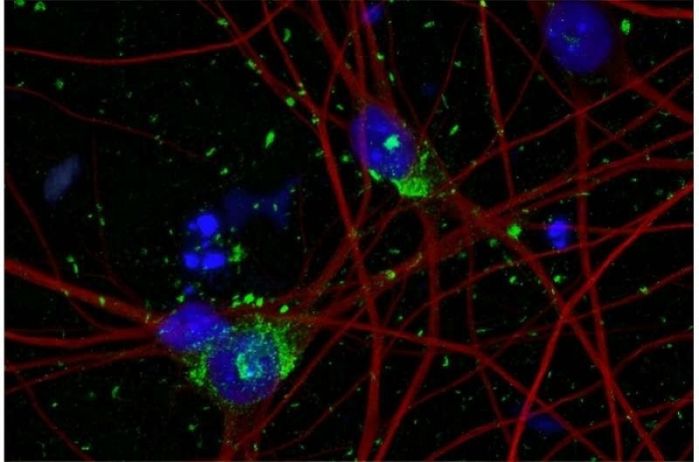
人类干细胞衍生神经元染色图揭示了细胞核(蓝色)、神经元细胞骨架(红色)和tau蛋白聚集体(绿色)内的DNA。图片来源:物理学家组织网
研究人员指出,目前没有任何疗法可阻止阿尔茨海默病患者大脑中tau蛋白聚集体的传播。他们开发的tau蛋白传播人类神经元模型克服了以前模型的局限性,揭示了药物开发的新治疗靶点。
人类多能干细胞可发育成身体的任何细胞,包括神经元,用于模拟大脑疾病。但此前科学家几乎不可能对多能干细胞产生的年轻神经元中的tau蛋白传播进行建模,因为tau蛋白是在衰老大脑内持续传播,长达几十年。
鉴于此,研究团队使用CRISPR技术修改了人类干细胞基因组,促使它们表达与衰老大脑相关的tau蛋白。他们发现,这个模型在几周内模拟出tau蛋白在神经元内的传播。
为阻止tau蛋白传播,研究团队使用CRISPR技术使1000个基因失活,以确定它们在tau蛋白传播中的作用。结果发现,其中有500个基因对tau蛋白丰度有重大影响。
研究团队表示,CRISPR技术使他们能够寻找新的药物靶点。比如,他们首次发现了UFMylation级联反应与tau蛋白传播的联系。UFMylation涉及UFM1蛋白与其他蛋白的连接。对阿尔茨海默病患者大脑组织的尸检研究发现,UFMylation过程存在异常改变。该团队还在临床前模型中发现,抑制UFMylation所需的酶阻断了tau蛋白在人类和小鼠模型神经元中的传播。(记者 刘霞)










